創薬における研究開発から承認、市販後調査までの仕事をご紹介します。
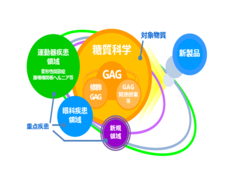
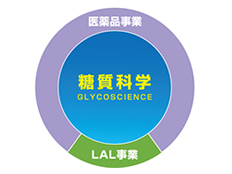
生化学工業では、候補物質の探索といった創薬の初期段階から後期段階の育薬まで、一貫した体制のもと研究開発を進めています。
|
研究
|
|---|
| 糖鎖基盤研究 / 合成研究 / 薬理研究 / 探索製剤研究 |
| ・新規化合物の合成 ・標的分子の探索 ・スクリーニング ・製剤化研究 |
化合物の合成や、培養、抽出を行い、目標とする疾患に有効な物質(新薬候補品)を見つけ出します。製造手法をほんの少し変えるだけで驚くほど性質が変わってしまうため、一筋縄ではいかない研究が多いのも探索研究の特徴の一つです。新薬開発の根幹となるところに携わるため、薬を一から創り出すことを実感できる研究でもあります。

|
研究
|
|---|
| 薬理研究 / 安全性代謝研究 |
| ・薬効薬理試験 ・薬物動態試験 ・安全性試験 |
新薬候補品の薬効を評価し、そのメカニズムを解析します。薬効が出にくいものを評価することも数多くあり、その中で、薬になりえる候補化合物を見つけ出すのは難しく、適切な評価系を構築して、精度の高いデータを出す能力が求められます。また臨床試験における安全性を確保するため、新薬候補品を生体へ投与した際の副作用等につながる特性を評価し安全性を確認します。
特
許
戦
略
知
的
財
産
部
※

|
研究 (CMC)
|
|---|
| 製剤技術研究 / 品質開発研究 |
| ・医療品製剤設計 ・工業化検討 ・試験法開発 ・治験薬品質保証 |
新薬候補品の物理的、化学的な性質の調査、製剤設計、製造法の確立、治験薬品質保証等を行います。臨床試験に向けて厳密な製造・品質管理の基にモノづくりを進めていく必要があり、慎重を要する研究です。研究から生産までの一貫した体制で新薬開発のスピードアップを図っています。

|
臨床開発
|
|---|
| 臨床開発部 |
| ・臨床試験(治験) |
実験の結果、ヒトを対象とし、有効性と安全性を評価します。この臨床試験で有効性と安全性が確認されない限り、新薬として製品化されることはありません。また新薬として承認を得るためには、倫理性と科学性の基準を満たした適切で正確なデータ収集が極めて重要となります。医師と共に仕事を進めることも多々あり、高い専門性が必要となります。

|
承認申請
|
|---|
| 薬事部 |
| ・審査当局対応 |
ヒトを対象とし、有効性と安全性が確認された新薬候補品に対して、製造・販売の承認の申請を行います。具体的には承認申請書類や実験結果をまとめ、独立行政法人医薬品医療機器総合機構および各国の審査当局に提出し、厳密な審査を受けます。その結果、審査をパスした新薬候補品には「医薬品」として製造・販売する承認を得ることができます。
※知的財産部は研究(探索)~承認申請の段階まで様々なプロセスに携わっています。

|
生産
|
|---|
| 生産技術部 / 品質保証部 / 工場など |
| ・生産技術 ・品質保証 ・品質管理 ・製造 |
新薬候補品を「医薬品」として患者さんへ提供するための最終ステージです。研究から開発、承認申請まで、携わった全社員の努力の結晶である「医薬品」を安全かつ安定的に生産し、世の中へ提供します。また徹底した品質管理や、医療機器製品の改良などもこの仕事の重要な役割の一つです。品質の高い「医薬品」を安定的に提供し続けるために、高い専門性と柔軟性が求められます。

|
育薬
|
|---|
| 事業推進部 / 海外事業推進部 / メディカル活動推進室 / 安全管理部 / 品質保証部 |
| ・販売(営業) ・市販後調査試験(GPSP) ・安全管理(GVP) ・品質管理(GQP) |
当社は、医薬品のMR要員を持たず、それぞれの製品領域で強みを持つ販売提携会社を通じて販売しています。
当社の営業部門は販売戦略の立案や実行、学術情報の提供等を通じて販売提携会社をサポートしています。また、市販後はより多くの幅広い患者さんに投薬されるため、開発段階では発見できなかった副作用や適正な使い方などの情報収集・検討など、市販後の安全管理、品質保証が義務付けられています。次の新薬開発のヒントを得ることもあるなど、これらの業務は多くの可能性を秘めた重要な仕事です。