現在、公表している製品パイプライン(開発品の状況)は次のとおりです。
<医薬品>
| 開発コード・物質名 | 適応症 | 開発地域 | 段階 | 備考 |
|---|---|---|---|---|
| SI-6603 コンドリアーゼ |
腰椎椎間板 ヘルニア |
米国 | 申請 | フェリング・ファーマシューティカルズ社 (スイス)と海外におけるライセンス 契約を締結 |
| Gel-One 架橋ヒアルロン酸 |
変形性関節症 (膝及び股関節) |
日本 | 第III相 | 小野薬品工業株式会社と 日本における共同開発及び 販売提携に関する契約を締結 |
| SI-722 ステロイド結合 コンドロイチン硫酸 |
間質性膀胱炎 | 米国 | 第I/II相 |
<医療機器>
| 開発コード・物質名 | 品 名 | 開発地域 | 段階 | 備考 |
|---|---|---|---|---|
| SI-449 コンドロイチン硫酸 架橋体 |
癒着防止材 | 日本 |
申請 |
(2025年8月20日現在)
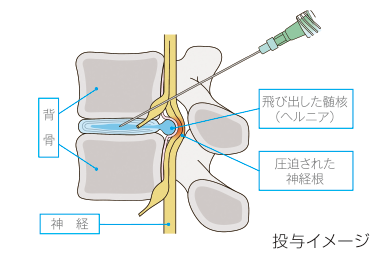
コンドリアーゼを有効成分とし、椎間板内に直接注射する腰椎椎間板ヘルニア治療剤です。全身麻酔の必要がなく、手術療法と比較して患者の方々への身体的負担が小さいという特徴を有しています。本剤は1回の注射で椎間板内圧を低下させ、神経根の圧迫を軽減させることで、腰椎椎間板ヘルニアの症状の改善が期待できることから、新たな治療選択肢として、患者の方々の生活の質の向上に貢献できるものと考えています。
国内では、2018年3月に「ヘルニコア椎間板注用1.25単位」として製造販売承認を厚生労働省より取得し、同年8月1日に発売しました。
2018年2月より米国で実施している追加の第Ⅲ相臨床試験は、2022年3月に被験者組み入れが完了し、2023年5月に主要評価項目において統計学的に有意な改善効果を示すトップライン結果を取得しました。また、2024年5月には米国食品医薬品局(FDA)により本剤に関する生物製剤承認申請(BLA)が受理されました。
今後、承認取得に向けた審査対応を進めます。
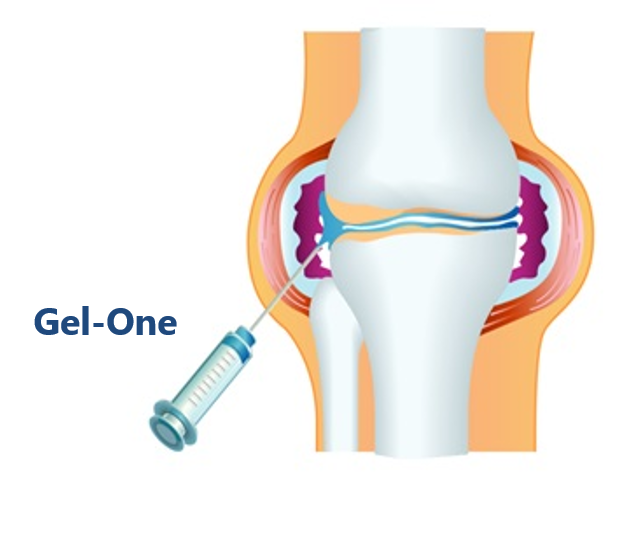
当社独自の架橋技術を用いて創製した架橋ヒアルロン酸を有効成分とする関節注射剤です。膝関節腔内投与後、関節局所に長く残留することが確認されており、1回の投与で長期の疼痛抑制効果が期待されます。
海外では2012年以降、「Gel-OneⓇ」(米国)や「HyLinkⓇ」(台湾、イタリア)として販売しています。
国内では2025年2月より、下記3つの試験を開始しています。
・変形性関節症(膝関節)を対象とした第Ⅲ相臨床試験
・変形性関節症(股関節)を対象とした第Ⅲ相臨床試験
・両関節を対象とした長期投与試験
海外では膝関節を適応範囲としていますが、国内では膝関節に加え股関節を対象とする試験も並行して実施し、対象となる患者層の拡大を目指します。
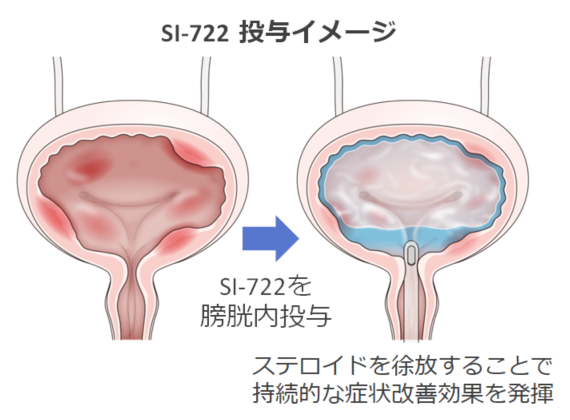
当社独自のグリコサミノグリカン修飾技術やドラッグデリバリーシステムを活用し、コンドロイチン硫酸にステロイドを結合させた新規の化合物です。膀胱内に注入したSI-722が抗炎症作用を有するステロイドを徐放することで、持続的に頻尿や膀胱痛などの症状改善作用を発揮すると考えられます。
第Ⅰ/Ⅱ相臨床試験において取得したデータをもとに、今後の開発方針について検討を行っています。
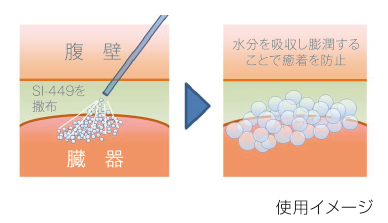
当社独自のグリコサミノグリカン架橋技術を用いて創製した、コンドロイチン硫酸架橋体を主成分とする粉末状の医療機器です。水分を吸収し膨潤する特性を有しており、撒布後に手術創部と周辺組織の間でバリアとなることで、外科手術における術後癒着の防止効果が期待されます。本テーマは国内のみならず、グローバル展開を視野に入れて開発を進めていきます。
2020年5月から実施した消化器外科領域におけるピボタル試験は、2022年9月に被験者組み入れが完了し、2023年7月に主要評価項目及び副次評価項目において、統計学的に有意な癒着防止効果を示すトップライン結果を取得しました。
また、適用範囲の拡大を目的とした婦人科領域におけるパイロット試験において、安全性と操作性に大きな問題は認められませんでした。
両試験の結果を受け、2025年8月に製造販売承認の申請を行いました。
今後、承認取得に向けた審査対応を進めます。